CRISPR技术自2012年诞生以来凭借其卓越的性能,迅速崛起为最先进且高效的基因编辑工具,为基因功能研究、药物靶点筛选、遗传疾病治疗、癌症研究以及作物育种等领域带来了革命性的突破。因其杰出的贡献,科学家Emmanuelle Charpentier和Jennifer A. Doudna在2020年荣获诺贝尔化学奖。本文将对CRISPR技术的核心原理及其工作机制进行深入剖析。

01
CRISPR系统介绍
01
CRISPR系统组成
CRISPR是“成簇规律间隔短回文重复序列”(clustered regularly interspaced short palindromic repeats)的缩写,CRISPR系统是原核生物(包括细菌和古生菌)的一种天然防御机制,用于抵御噬菌体病毒的感染。
CRISPR/Cas系统由两个部分:CRISPR基因序列与Cas基因组成。
CRISPR基因序列
由前导序列(leader)、重复序列(repeat)和间隔序列(spacer)构成:
1)前导序列:一段富含AT碱基的数百个碱基对,坐落于CRISPR基因的上游,并发挥着启动子的关键作用。
2)间隔序列:细菌所俘获的外源DNA片段的记录,它们像是CRISPR系统的“记忆库”,当相同的外源遗传物质再次尝试入侵时,CRISPR/Cas系统会精准地识别并予以打击。
3)重复序列:长度约20–50bp碱基,内含5–7bp的回文序列,其转录产物能够形成发卡结构,从而稳定RNA的整体二级结构。这些重复序列与间隔序列相互交错,数量从几个到数百个不等。
cas基因
Cas基因,位于CRISPR基因附近或散布于整个基因组的其他位置,它们所编码的蛋白质包括Cas1至Cas10等。这些蛋白质在CRISPR/Cas系统中扮演着关键角色,与CRISPR基因序列协同工作,共同构成了这一强大的防御机制,从而保护原核生物免受噬菌体病毒的侵害。

02CRISPR系统分类
CRISPR/Cas系统,根据其Cas蛋白的组成差异以及效应复合物的特性,可以被分为两大类:Class1和Class2。
Class1系统:
这个类别的系统特征在于它包含一个由多个Cas蛋白构成的效应模块。该模块承担着识别目标基因组、失活入侵DNA以及处理前CRISPR RNA(也称为pre-crRNA)的关键任务。
Class2系统:
与Class1不同,Class2系统的标志性特征是它包含一个单一的多结构域CrRNA结合蛋白,比如在Class2系统中的Cas9。这种蛋白质具备实现干扰所需的全部活性,并且在一些变体中,它还整合了参与前crRNA加工的活性。
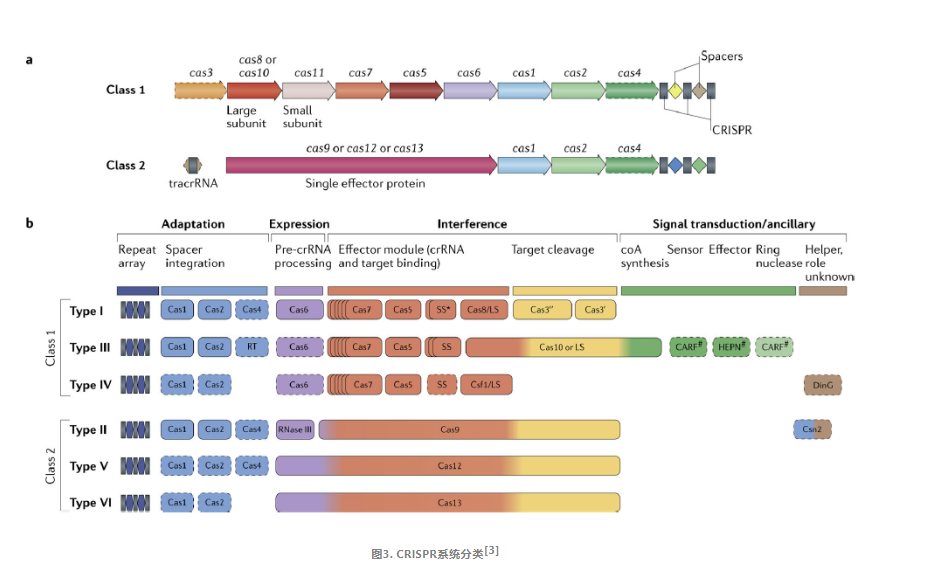
CRISPR/Cas系统中的Cas基因可以归纳为四个不同但部分重叠的功能模块:适应模块、表达处理模块、干扰或效应模块、信号转导或辅助模块,这些模块共同协作以实现其基因组编辑的能力。
1)适应模块:负责将新的遗传信息整合到CRISPR序列中。它包括编码关键酶Cas1(负责间隔序列的插入)和适应复合体亚单位Cas2的基因。此外,它还可能包含Cas4核酸酶、II-A亚型中的Csn2蛋白以及许多III型系统中的逆转录酶。
2)表达处理模块:负责前crRNA处理。在大多数Class1系统中,Cas6是直接负责这一过程的酶。而在II型系统中,这一任务由细菌RNase III(一种非Cas蛋白)完成。在许多V型系统和所有VI型系统中,大型效应Cas蛋白内含一个专门的催化中心来处理前crRNA。
3)干扰或效应模块:涉及目标识别和核酸裂解。在Class1系统中,效应蛋白模块由多种Cas蛋白组成,如Cas3、Cas5-Cas8、Cas10和Cas11等。而在Class2系统中,效应蛋白模块简化为单一的大蛋白,如Cas9、Cas12或Cas13。
4)信号转导或辅助模块:这是一个包含众多CRISPR连锁基因的广泛集合,它们在CRISPR-Cas系统中的作用大多是初步预测的。
由于Class2系统的简便性和易用性,研究者主要关注Class2系统中的Cas亚型,以寻找潜在的新基因组编辑和诊断工具。Class2 CRISPR-Cas系统主要包括三种类型:II型(cas9)、V型(cas12)和VI型(cas13)。
II型系统
Ⅱ型系统中的代表为CRISPR/Cas9蛋白系统,Cas1、Cas2、Cas4蛋白负责重复间隔区的建立,RNaseⅢx协助crRNA的形成,而剩余的工作由Cas9蛋白完成。Cas9发挥功能时需要tracrRNA与crRNA共同作用(tracrRNA促进crRNA加工成熟,通过碱基配对与crRNA结合形成tracrRNA/crRNA复合,用于结合Cas9蛋白;crRNA与基因组DNA互补配对,用于结合模板DNA),当向导RNA与Cas9蛋白形成复合物后,Cas9蛋白的两个DNA切割结构域(HNH和RuvC)发挥切割活性,HNH结构域切割与crRNA互补的链,RuvC结构域切割另一条链,从而实现了对目标DNA的双链切割,这种精准的切割能力使得CRISPR/Cas9系统成为了基因编辑领域中最强大、最高效的工具之一。
V型系统
V型系统的单一效应蛋白为Cas12,与II型系统存在显著差异。II型系统依赖于两个DNA切割结构域——HNH和RuvC,而V型系统则仅拥有一个与RuvC相似的切割活性结构域;在guideRNA上,Cas9系统需要tracrRNA与crRNA的协同作用,而Cas12a系统则仅凭单一的crRNA便能完成使命。
值得一提的是,Cas9蛋白在切割双链DNA后,产生的DNA末端为平末端。相比之下,Cas12a系统则会产生粘性末端,这一特性为其在基因编辑和核酸检测等领域的应用提供了更多可能性。
此外,像Cas12a、Cas12b这样的系统还具有反式切割活性。在crRNA的引导下,Cas12a能够特异性地识别和切割双链DNA(dsDNA),并随后释放单链脱氧核糖核酸酶(ssDNase)活性。这种活性使得Cas12a能够无差别地裂解附近的单链DNA(ssDNA)。因此,Cas12a系统可以与LAMP等技术相结合,为核酸检测等领域提供强大的工具。

VI型系统
VI型系统的单一的效应蛋白为Cas13,具有靶向切割目标RNA的能力。Cas13含有两个高等真核生物和原核生物核苷酸(HEPN)结合域结构,其上的RxxxxH保守基序是Cas13核酸酶催化活性位点。Cas13仅凭单个crRNA的引导,便能催化自身的前体pre-crRNA转化为成熟的crRNA,当crRNA-Cas13a复合物形成时,crRNA便会引导复合物与靶标RNA进行碱基互补配对。通过这种机制,Cas13能够特异性地对靶标RNA进行顺式剪切,从而实现RNA敲除的目的。此外,Cas13还能以非特异性的方式对附近的RNA进行反式剪切,这一特性使其在基因编辑和RNA调控领域具有广阔的应用前景。
02
CRISPR/Cas系统的作用机理
CRISPR/Cas系统的具体作用机可分为以下三个阶段:
01
获得CRISPR的高度可变的间隔区
当被外源噬菌体或质粒侵入时,含有CRISPR的细菌和古菌获得插入间隔区的外源DNA片段;
02
CRIPSR基因座的表达
当与间隔区同源的外来核酸再次进入细菌时,CRISPR阵列会被激活并转录产生前体crRNA(pre-crRNA)。同时,与pre-crRNA序列互补的tracrRNA也会被转录出来,tracrRNA在转录后会首先与Cas9蛋白结合,随后与pre-crRNA通过互补碱基配对形成双链RNA。这个双链RNA与Cas9蛋白结合,形成一个功能强大的复合物。
在RNase III的作用下,pre-crRNA经历初级和二次加工,多余的重复序列和间隔序列被去除,从而生成成熟的crRNA。这个成熟的crRNA具备了靶向特定DNA链的能力。
03
CRISPR/Cas系统活性的发挥(靶向干扰)
若细菌再次遭受同源DNA的感染,它会启动CRISPR区域的转录,经过一系列的加工和成熟过程,生成单链向导RNA(sgRNA),sgRNA会引导Cas9蛋白精确地剪切并破坏同源间隔区域的DNA链,导致双链DNA断裂(DSB),随后,细胞会通过非同源末端连接(NHEJ)或同源重组(HDR)的方式对靶基因进行修复。这一过程中,CRISPR/Cas系统展现出了其精确的靶向干扰能力,从而有效地抵御了外源遗传物质的入侵。

03
CRISPR/Cas系统编辑基因组原理
(CRISPR/Cas9系统)
RISPR/Cas9基因编辑系统依赖于两大核心组件:具备导向功能的gRNA和Cas9蛋白。其技术原理涵盖了两个基本过程:gRNA引导的Cas9靶向DNA切割,以及随后的DNA修复。
01
Cas9靶向DNA切割
在Cas9靶向DNA切割阶段,CRISPR系统识别DNA上的特定位置,这一识别过程依赖于crRNA(负责识别)和tracrRNA(作为Cas9的结合支架)的序列。当这两者融合转录出sgRNA后,sgRNA与Cas9蛋白结合形成复合体,通过sgRNA与20bp靶序列的互补配对,Cas9核酸内切酶被精确引导至靶切割位点,切割从PAM(即复合体识别的富含GC的三碱基序列,如5′-NGG-3′)上游的第三个碱基开始。Cas9核酸内切酶包含两个关键结构域:HNH核酸酶结构域和RuvC-like核酸酶结构域。这两个结构域协同工作,共同切割DNA。其中,HNH核酸酶结构域负责切割与crRNA互补的DNA链,而RuvC-like结构域则切割另一条非互补链。切割位点位于PAM上游原始间隔序列的第3和第4个核苷酸之间,产生平末端的DSB(双链断裂)。一旦Cas9/sgRNA复合物诱导产生DSBs,机体将启动两种修复方式,从而实现对靶基因表达的精准调控。
图6. CRISPR-Cas9介导的基因编辑机制[6]
02
DNA修复
1)非同源末端连接(NHEJ)
非同源末端连接(NHEJ)是修复双链断裂(DSB)的经典通路。在这一过程中,断端会经历核酸酶的精细修剪和DNA聚合酶的空隙填补,然而,这种修复方式会在DNA上留下“痕迹”,可能是修复过程中错误插入或缺失的碱基。当这些“痕迹”出现在基因组的编码蛋白基因区域时,会导致基因编码的蛋白序列出现异常,进而造成相应蛋白功能的失调。
然而如果“痕迹”出现在基因组的非编码区,其对细胞的整体功能通常不会造成显著影响。例如,在基因敲除实验中,我们常常选择在翻译起始位点后的外显子区域设计gRNA,以确保其尽可能靠近mRNA的5’端。这样做的目的是,插入或缺失的碱基会干扰正常的密码子读码,导致翻译过程提前终止,从而破坏目标基因的表达或使其功能丧失。
2)同源重组修复(HDR)
同源重组修复(HDR)是一种基于遗传重组的DNA修复机制,它发生在两个相似或相同的DNA分子核苷酸序列之间。HDR的一个显著特点是,在修复过程中不会引入额外的核苷酸缺失或增加,因此它能够精确地修复DNA双链的断裂。例如,在制备疾病相关突变模型时,我们可以通过外源提供包含所需突变的靶基因模板,然后利用HDR机制,在Cas9蛋白切割DNA后,将突变模板精确地整合到基因组中。
CRISPR/Cas技术作为新一代基因编辑技术的代表,具有极为广阔的应用前景。在本文中,我们向大家介绍了CRISPR/Cas系统的基本组成和编辑机制。而在接下来的文章中,我们将深入探讨CRISPR/Cas技术的递送形式及应用,敬请期待!
为了助力广大用户更深入地理解并运用CRISPR技术,翌圣特别推出基因编辑产品组合包限时低价:
活动细则:
1、活动时间:2024年3月18日-2024年5月18日;
2、活动对象:本活动面向全国终端客户;
3、本活动限制参与次数,不支持多笔订单累积,仅支持单笔订单累计;
4、本活动不与其他任何活动叠加,非产品质量问题,活动订单内产品不支持退换货行为;
5、 活动期间内所有订单及赠品均需在活动结束后5天内完成出库,过期兑换无效;
6、活动名额有限,每位客户限购一次,每种组合限量20套,售完即止。
参考文献:
[1] The Nobel Prize in Chemistry 2020, Retrieved October 7, 2020, from https://www.nobelprize.org/prizes/chemistry/
[2] Marraffini LA, Sontheimer EJ. CRISPR interference: RNA-directed adaptive immunity in bacteria and archaea. Nat Rev Genet. 2010;11(3):181-190.
[3] Makarova KS, Wolf YI, Iranzo J, et al. Evolutionary classification of CRISPR-Cas systems: a burst of class 2 and derived variants. Nat Rev Microbiol. 2020;18(2):67-83.
[4] Pickar-Oliver A, Gersbach CA. The next generation of CRISPR-Cas technologies and applications. Nat Rev Mol Cell Biol. 2019;20(8):490-507.
[5] Jiang F, Doudna JA. CRISPR-Cas9 Structures and Mechanisms. Annu Rev Biophys. 2017;46:505-529.
[6] Westermann L, Neubauer B, Köttgen M. Nobel Prize 2020 in Chemistry honors CRISPR: a tool for rewriting the code of life. Pflugers Arch. 2021 Jan;473(1):1-2.
关于镁孚泰
镁孚泰生物科技(上海)有限公司(镁孚泰生物,Molefuture)是翌圣生物科技(上海)股份有限公司旗下的全资子公司,是一家以酶进化技术为驱动、专注于提供酶改造定制化解决方案的创新型企业。依托于翌圣生物,镁孚泰生物现有六大技术平台:ZymeEditor创新酶进化平台、多宿主高效表达平台、发酵工艺开发平台、纯化工艺开发平台、超洁净酶生产平台以及酶分析与质控平台。基于这六大技术平台,镁孚泰生物可提供酶定向改造、新酶开发、酶工艺开发以及GMP级别规模化生产的全套定制解决方案,以满足酶在体外诊断、生物医药、合成生物、医疗美容、医药中间体等领域的应用需求。
关注镁孚泰官方微信公众号,获取更多酶改造知识!
